NBI観察による病変拾い上げとJNET大腸拡大NBI分類による質的・量的診断のポイント
佐野 寧 先生 [佐野病院 消化器センター]
1.より確実な病変拾い上げのための NBI観察法
大腸内視鏡では、スクリーニング検査(表1)における病変拾い上げの精度向上を目指し、モダリティの開発・改良やそれらを生かした観察・診断技術の工夫が行われてきました。特にNBI観察機能は内視鏡検査環境に大きな変化をもたらしており、その有用性について質の高いエビデンス構築も進められています。それらのエビデンスに基づき、当院で実施している最新のNBIを活用した観察法のポイントを紹介します(表2)。
表1 大腸スクリーニング内視鏡検査の適応の条件となる大腸癌リ スク因子
| ●大腸癌検診(便潜血検査)陽性 ●40歳以上 ●女性 ●下血や腹痛の症状 |
●大腸癌の家族歴 (特に50歳以下での発症例) ●アルコール多飲 ●喫煙 ●運動不足 |
| 検査ステップ | 観察方法 | ||||
|---|---|---|---|---|---|
| ① | ス ク リ ー ニ ン グ |
挿入時 | 発赤の検出 | 白色光観察 | |
| ② | 抜去時 | brownish area(腫瘍性病変の 疑い)、赤い粘液 |
NBI非拡大観察 ※胆汁が多い部分では白色光観察 |
||
| ③ | 診 断 |
病変全体の把握 | NBI非拡大観察 | ||
| ④ | 関心領域の絞り込み (最も深達度が深い部分の把握) |
M-NBI観察/ 色素拡大内視鏡観察 |
弱拡大 | ||
| ⑤ | 質的診断 | 中拡大 | |||
| ⑥ | 量的診断(範囲診断、深達度診断) | 強拡大 | |||
表2 大腸内視鏡検査における観察方法と検査ステップの流れ
スコープ挿入時・抜去時の白色光・NBI使い分け
スコープ挿入時は白色光観察とし、この段階で可能な限り病変を拾い上げるつもりで注意深くスコープを進め、盲腸まで到達します。盲腸は襞が高く病変を見つけづらいうえ、回盲弁の裏や盲腸底部には大腸癌前駆病変として近年、非常に注目されているSSA/P(sessile serrated adenoma/polyp)が高頻度に出現します。そのため必要に応じスコープに反転操作も加えながら、慎重に観察します。
抜去時は、最新の内視鏡システムであるEVIS LUCERA ELITEシステムと290シリーズのスコープを組み合わせて使用している場合には、NBI観察に切り替えた状態で抜去していきます。
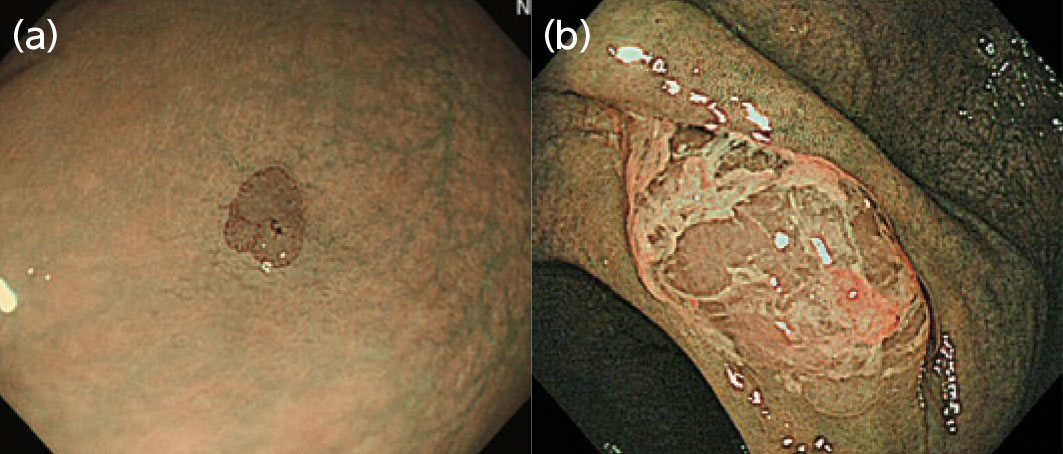
スコープ位置は、挿入時の白色光観察と同様、管腔中央とします。従来のNBIでは、明るさが足りなかったため、スコープを腸管壁に沿わせて観察しながらスパイラル状に抜去操作する必要がありました。しかしEVIS LUCERA ELITEシステムではNBIの明るさが改善したため、白色光観察と同様の抜去操作で問題なくなりました。そしてNBI下の観察所見で、腫瘍性病変を示唆する褐色調のbrownish areaを探します(図1a)。また右側結腸ではSSA/Pが好発するため、これを示唆する赤い粘液付着を探していきます(図1b)。
効率的かつ見逃さない観察のポイント
NBI観察では、粘膜表面に便汁や残渣が付着していると赤く見え、白色光下と比べても非常に観察がしづらくなります。290シリーズのスコープでは前方送水機能が搭載されており、これを活用して洗浄することで、効率的に観察・病変検出を進めることができます。
また大腸病変の拾い上げで見逃しが発生しやすい病変としては、白色光観察時、NBI観察時を問わず、上行結腸や横行結腸の襞が高い部位にある病変と考えられます。とりわけ平坦なLSTNGの場合は熟練した内視鏡医でも見逃されやすく、これらの部位の観察時には十分な注意が必要と言えます。
病変拾い上げに対するNBIの有用性を示した 多施設共同無作為化比較試験
従来、NBIが大腸病変拾い上げに有用かどうかについては、白色光観察と比較してNBIに明らかな優位性が認められるとするエビデンスは出されていませんでした。国内でも多施設共同の無作為化比較試験(RCT)が行われ、内視鏡システムにEVISLUCERA SPECTRUM、スコープにCF-H260AZIを用いて白色光観察とNBI観察の病変検出率が比較されましたが、両者の検出率は同等で、NBIの使用が検出率を向上させるという結果は得られませんでした1)。これは、従来のNBIでは白色光観察と比べて光量が足りず、視野が暗くなることが原因であったと考えられます。実際、臨床でNBIを使用していても、暗すぎて病変の拾い上げには適さないという実感がありました。
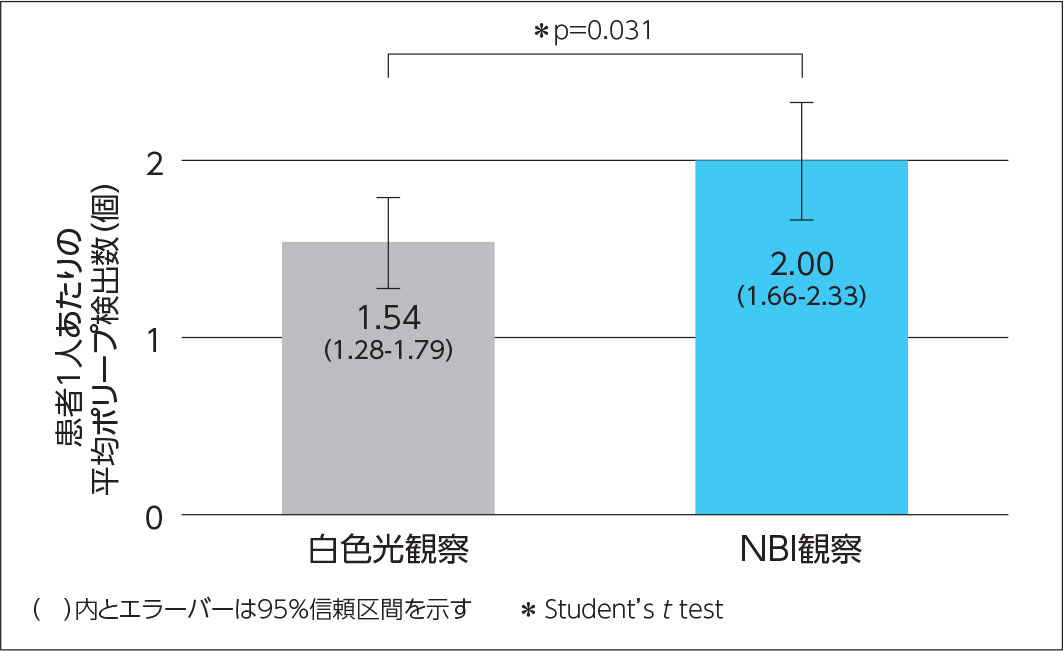
しかし2012年に観察性能の向上が図られた新しい内視鏡システムEVIS LUCERA ELITEが登場し、NBI観察時の明るさが大幅に改善されました。この新しい内視鏡システムに、スコープはCFH260AZIもしくはCF-HQ290を組み合わせて用い、再度、国内で5施設共同によるRCTが行われました。本検討では抜去時にのみ病変の探索を行うこととし、白色光観察群(218人)、NBI観察群(213人)ではそれぞれ全大腸を白色光、NBIで観察しました。その結果、患者当たり平均大腸ポリープ発見数は白色光観察群で1.54(95%信頼区間(CI):1.28-1.79)、NBI観察群で2.00(95%CI:1.66-2.33)とNBI観察の方に明らかな優位性が認められました(Student’s t test、p=0.031:図2)2)。拾い上げに対するNBIの有用性が明らかな病変は、サイズ5mm以下、肉眼型が平坦型のほか、SSA/Pでした2)。SSA/Pは本検討のNBI観察群でも検出率は5%あり2)、出現頻度の低い病変ではありません。そうした病変の拾い上げにもメリットが発揮されることから、NBIは 大腸のスクリーニング検査に必要不可欠のパワフルなツールであると言えます。
このエビデンスに基づき、当院のスクリーニング検査では、NBI観察時の明るさが改善された新しい内視鏡システムとスコープが使用できる場合、大腸病変のより確実な拾い上げへのメリットを期待して、抜去時に全大腸をNBI観察する手順としています。
2.M-NBI観察による質的・量的診断の手順
大腸病変の内視鏡診断における最終的な診断方法は従来、色素拡大内視鏡観察によるpit pattern診断であり、それに対してNBI診断は補助診断の位置づけです。ただし多くの症例では、M-NBI観察によるNBI診断のみで診断確定し治療方針を決定することが可能であり、そのためにこれまで複数のM-NBI観察所見の分類体系が提唱されていました3-6)。
最近、それらの統一分類としてJNET大腸拡大NBI分類7,8)が誕生しました。JNET分類を活用したM-NBI観察により、大腸病変の質的診断・量的診断をどのように行うことができるかについて解説します。
質的・量的診断のための病変アプローチ
スクリーニング検査で拾い上げた病変を、NBI非拡大観察で全体像をとらえたのち、拡大観察機能を用い、M-NBI観察で弱拡大から中拡大へと倍率を上げながらvessel pattern、surface patternが不整を示す部位を探していきます。
こうした観察手順により腫瘍・非腫瘍、癌・非癌を鑑別する質的診断、さらには量的診断へと進めることができます(表2)。大腸病変は多くの場合、腺腫ですが、一部が癌化した腺腫内癌や、過形成性ポリープの内部に腺腫性成分を伴う病変など、一つの病変内に異なる複数の成分が複雑に混在することがあるのが特徴です。そのため大腸病変の質的診断・量的診断では、胃の病変のように1ヵ所を最大倍率で観察するのではなく、弱~中拡大で異型度の高い領域を探して関心領域を絞り込み、さらに倍率を上げて精査していく診断アプローチが適しています。
上記のような手順で大腸病変の拡大観察を行う際、サポートデバイスとしてnon-traumatic tubeという先端が球形の染色用チューブを使用しています。スコープ鉗子口から突出させたチューブ先端部で病変近傍の粘膜表面を押さえることにより、呼吸性変動の影響を抑え込んで一定の距離を確保できるため、拡大観察時の焦点合わせが容易となります。またスコープ先端が病変に衝突して出血を起こすリスクも避けられます。
JNET分類を活用した質的・量的診断
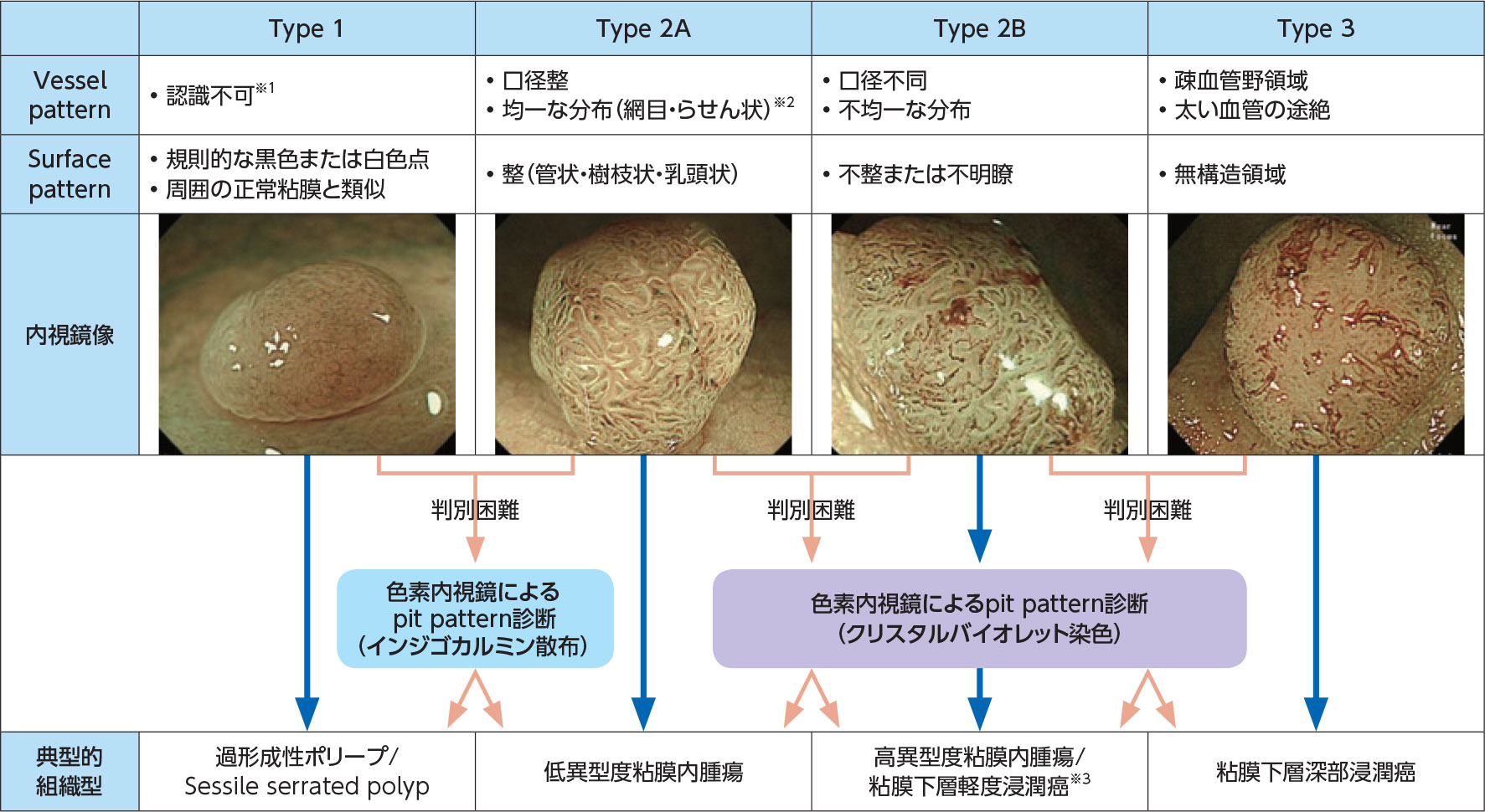
統一分類としてのJNET分類7,8)作成に先立って私たちのグループが提唱していた佐野分類3)は、血管所見のみに基づく分類でした。腺腫を非腫瘍性病変から鑑別するポイントとして、佐野分類では網目状を呈するmeshed capillary vessels所見に着目するのが特徴です。しかし実際は多くの内視鏡医の先生方がsurface patternも手掛かりに腫瘍・非腫瘍の鑑別を行っていることから、vessel pattern、surface patternの両所見を取り入れた分類としてJNET分類が作成されました(図3)。
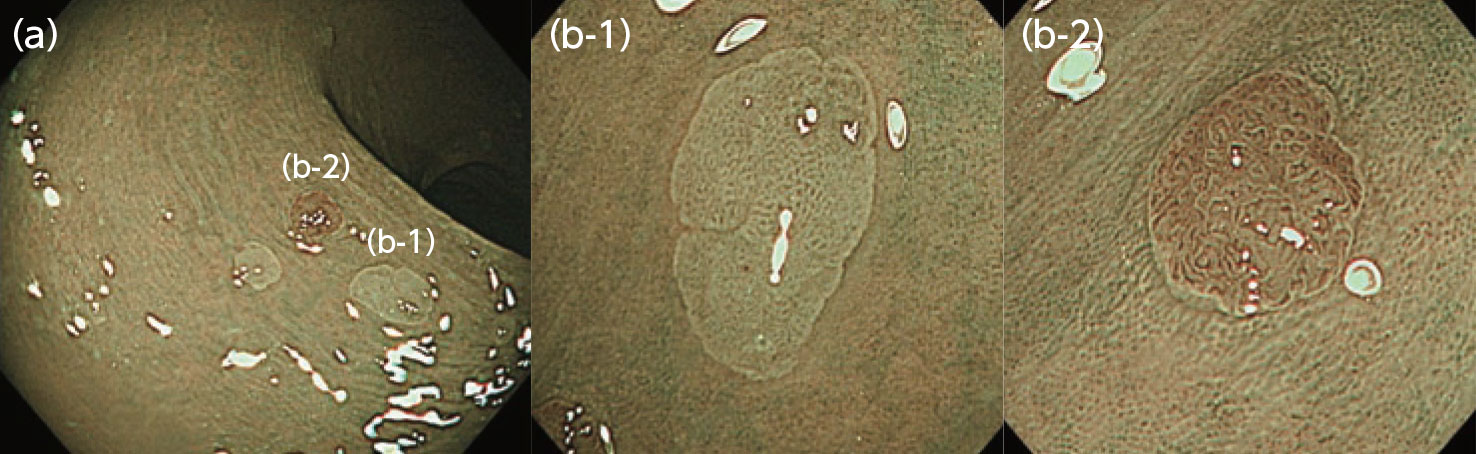
JNET分類におけるType 1とType 2Aの判別は、腫瘍・非腫
瘍の鑑別に相当し、通常はサイズ1cm以下の病変を対象に行われます。まずNBI非拡大観察で周囲の正常粘膜と同色もしくはやや白色調を呈し(図4a)、続いて拡大倍率を上げたM-NBI観察で血管が明瞭に認識できない、あるいはsurface patternが白色もしくは黒色のドット状に見える場合にはType 1に該当します(図4b-1)。Type 1の組織型はほとんどの場合、過形成性ポリープです。これに対しType 2Aに該当する病変では、NBI非拡大観察では褐色調を呈し(図4a)、M-NBI観察では血管が明瞭に認識されるとともにvessel patternとして腺口周囲に血管が均一に分布している様子、あるいは口径が均一な様子が観察されます(図4b-2)。もしくはsurface patternが楕円状や管状、脳回状に観察されます(図4b-2)。こうしたType 2Aの組織型は腫瘍性病変です。ただしこのようなM-NBI観察所見に基づくType 1・2Aの判別はサイズ3~5mm以下になると時に難しく、そうした場合はインジゴカルミン散布を用いた色素拡大内視鏡観察によるpit pattern診断が必要となります(図3)。
Type 1・2Aの判別に際しては、vessel patternとsurface patternの所見が食い違う症例がみられることがあります。Type 2A・2Bや2B・3の判別についても、腺腫から癌、浸潤癌へと連続的に変化する病変を分類するため、判別困難なグレーゾーンの症例が一定の割合でみられます。こうした症例の診断を確定するのに、Type 1・2Aの判別に迷う場合はインジゴカルミン散布、Type 2A・2Bや2B・3の判別の場合はクリスタルバイオレット染色ののち、色素拡大内視鏡観察でpit pattern診断を行うことが必要となります(図2)。Type 2AともType 3とも判別が問題になるType 2BはJNET分類において最も判別が難しく、vessel patternとsurface patternの所見がType 2Bに該当した症例は基本的に全例、pit pattern診断が必要と考えています。JNET分類の全4カテゴリーの診断能を評価した国内の大学 病院による検討でも、Type 2Bの特異度、陽性的中率は他の3カテゴリーより明らかに低いことが示され、その的確な組織型診断にはpit pattern診断の追加が必要であることが示唆されています9)。ただし内視鏡診断技術のラーニングカーブを考えると、熟練するほどJNET分類のM-NBI観察所見のみでより的確に組織型診断できるようになり、pit pattern診断を要する症例の割合は減っていくという印象を持っています。
1)Ikematsu H, et al. J Gastroenterol 2012; 47: 1099-1107.
2)Horimatsu T, et al. Int J Colorectal Dis 2015; 30: 947-954.
3)Ikematsu H, et al. BMC Gastroenterology 2010; 10: 33.
4)Tanaka S, et al. Gastroenterol Endosc 2008; 50: 1289-1297.
5)Nikami T, et al. Gastroenterol Endsc 2009; 51: 10-19.
6)Wada Y, et al. Gastrointest Endosc 2009; 70: 522-531.
7)Sano Y, et al. Dig Endosc 2016; 28: 526-533.
8)佐野寧ほか. INTESTINE 2015; 19: 5-13.
9)Sumimoto K, et al. Gastrointest Endosc 2016;
doi: 10.1016/j.gie.2016.07.035. [Epub ahead of print]