京都大学大学院医学研究科 放射線腫瘍学・画像応用治療学分野 教授
平岡 真寛 先生
1977年京都大学医学部卒業。87年米国スタンフォード大学放射線腫瘍科Visiting Professorとして温熱療法の基礎研究を行う。その後、89年京都大学医学部放射線医学講座講師、92年同助教授として高精度放射線治療の研究を推進し、95年京都大学大学院医学研究科腫瘍放射線科学(2005年分野名変更 放射線腫瘍学・画像応用治療学)教授就任。08-12年には、日本放射線腫瘍学会の初代理事長を務めた。産学官連携功労者表彰経済産業大臣賞「高精度がん放射線治療装置の開発」、日本癌治療学会中山恒明賞、一般財団法人機械振興協会第10回新機械振興賞会長賞、文部科学大臣表彰科学技術賞(開発部門)「動体追尾放射線治療システムの開発」など受賞。
1. はじめに
■ 動体追尾体幹部定位放射線治療の必要性
臨床病期I期の非小細胞肺癌で、低肺機能や合併基礎疾患、高齢、手術拒否などの理由で手術適応にならない患者に対しては放射線治療が考慮される。近年、検診の普及による早期肺癌が発見される機会の増加および高齢化の進行に伴い、手術の適応とならない早期肺癌に対する有効な治療法への必要性はより高まってきている。体幹部定位放射線治療は、高線量の放射線を高い位置精度で局所に集中させることによって、従来よりも局所制御率の改善と合併症の軽減を図ることができる治療法であり、その有用性および安全性が示されている。
呼吸により大きく動く肺癌に対し体幹部定位放射線治療を施行する際には、適切な呼吸性移動対策が不可欠である。肺に照射される線量が増加すると放射線肺臓炎の頻度が増加するため、呼吸の動きによる照射野拡大は最小限にしつつ、かつ呼吸によって動く腫瘍が照射範囲から外れないよう治療しなければならない。現在用いられている呼吸性移動対策法のうち、自由呼吸下で全呼吸位相にわたり照射する動体追尾照射法は、照射時間の延長なく患者への負担は最小限で照射範囲を縮小することができる理想的な方法である。
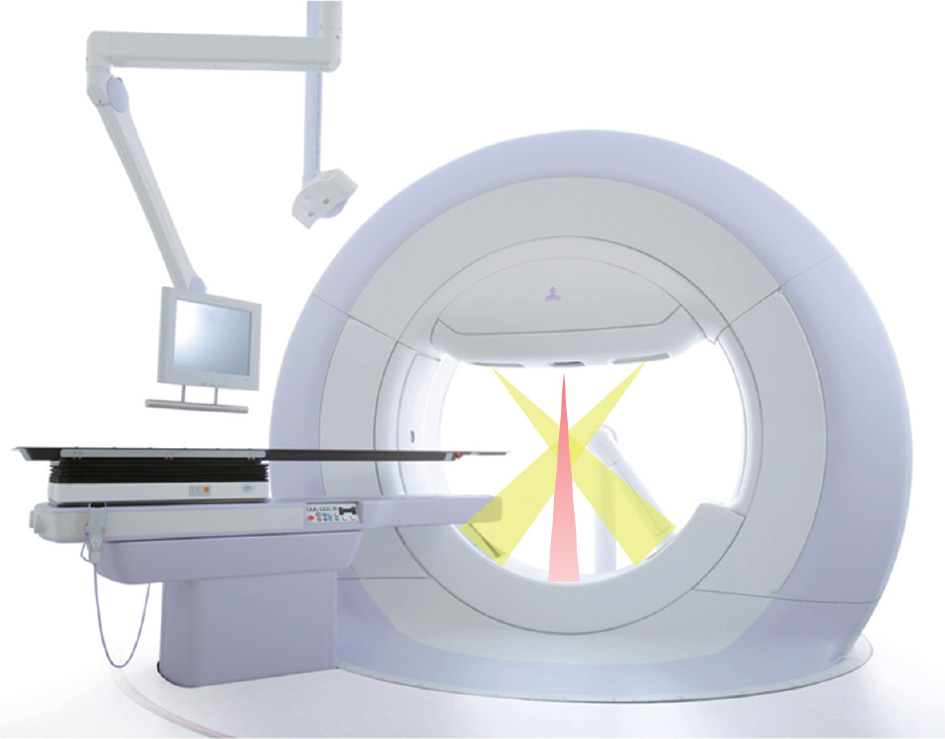
しかし、体内で常に動く腫瘍を正確に追尾照射するためには、その位置をリアルタイムに認識して照射する必要がある。Vero4DRTのリング型のガントリには、2対のkV X線透視イメージングシステムや治療ビームを画像化するEPIDといった画像誘導システムと、二軸方向に独立してそれぞれ2.5度(アイソセンター面で4.2cm)ずつ首振り照射が可能なジンバル機構を備えた照射ヘッドが搭載されている。また、室内天井には赤外線カメラが設置されており、体表に置いた赤外線反射マーカーの位置から患者の動きを常に把握することができる。Vero4DRTのこれらの機能を生かすことで、照射中もリアルタイムに腫瘍位置を確認しながら高い精度で追尾照射を行うことが可能となった。
■ 治療の適応
体幹部定位放射線治療は2004年度に保険収載されており、肺腫瘍では①直径5cm以下で転移のない原発性肺癌、②直径5cm以下で肺以外に病巣のない三個以内の転移性肺癌が適応となる。間質性肺炎・肺線維症の合併例では、放射線肺臓炎が起こるリスクが高く適応には慎重になるべきである。
2012年度より呼吸による移動長が10mmを超える腫瘍に対し、呼吸性移動対策を行って照射野の拡大を各方向5mm以下に低減される場合には、呼吸性移動対策加算が算定できるようになった。
2. 方法
■ ゴールドマーカーの留置方法の実際
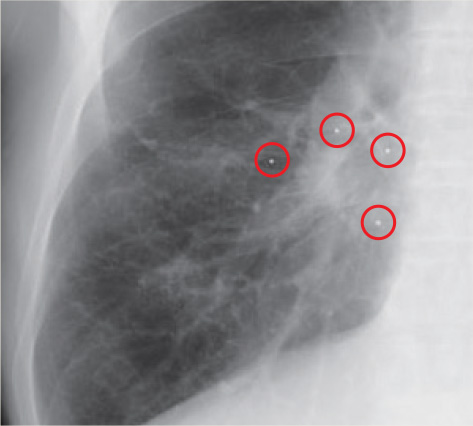
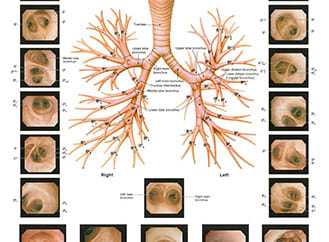
ゴールドマーカーを腫瘍位置の認識に用いる際には、脱落や移動に注意する必要がある。留置後一週間以内は脱落・移動が起こる可能性が高いため、治療計画CTの撮影日より一週間以上前に気管支鏡下でゴールドマーカーの留置を行っている。当院では呼吸性移動の大きい下葉病変を中心に留置を行っているが、留置されたゴールドマーカーのうち2割弱で脱落が認められる。近日中には2個以下のゴールドマーカーでの追尾治療に対応する予定であるが、現在のVero4DRTのシステムでは3個以上のゴールドマーカーが必要である。脱落を最小限にするために、極力気管支末梢に留置を行う。
しかし、気管支末梢に留置する際には気胸の合併にも注意しなければならない。そのため、ゴールドマーカーをシースから押し出す際には、経気管支肺生検施行時と同様にX線管球を接線方向まで回転させ、吸気のタイミングに合わせてX線透視下で胸膜直下の末梢気管支内に留置している。これまで留置を行った49例のうち1例で軽度の気胸を認めたが、他には明らかな合併症は認めていない。このように留置手技が比較的安全に実施できるということは、低肺機能や合併症を有する患者や高齢者を中心に行われる肺癌に対する体幹部定位放射線治療においては非常に重要である。
呼吸周期のうちの一部にしか照射しない呼吸同期照射法や動体迎撃法と違い、動体追尾照射法では全呼吸位相においてゴールドマーカーから認識した腫瘍位置に対して照射を行うため、腫瘍とゴールドマーカーとの間の動きの誤差が極力小さくなるように、ゴールドマーカーの重心と腫瘍重心の距離が近くなる位置に留置する必要がある。そのため、留置手技を行っていただく呼吸器内科の先生には、可能な限り腫瘍の近傍の気管支内に、かつ腫瘍を囲むようにゴールドマーカーを留置していただくようお願いしている。
■ Vero4DRTを用いたリアルタイムモニタリング下での 動体追尾照射の実際
動体追尾照射を行う際には毎回の照射前に、X線画像から得た腫瘍近傍のゴールドマーカーの動きと腹壁上の赤外線反射マーカー位置から得た腹壁の動きの間に相関モデルを作成し、その相関モデルに従って照射を行う。ビームを出す直前には直交二方向のX線透視画像で相関モデルから予測された腫瘍およびゴールドマーカーの位置が実際の位置と一致していることを確認してから照射を開始し、照射中もX線透視画像とEPIDで腫瘍が正確に照射されていることをリアルタイムにモニタリングを行う。また治療後にはログを解析することで追尾照射の精度を確認できる。

3. 結果
■ 症例
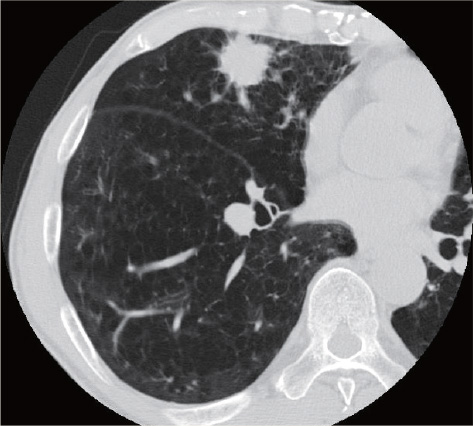
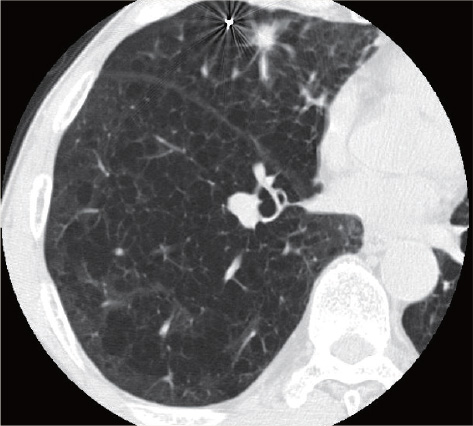
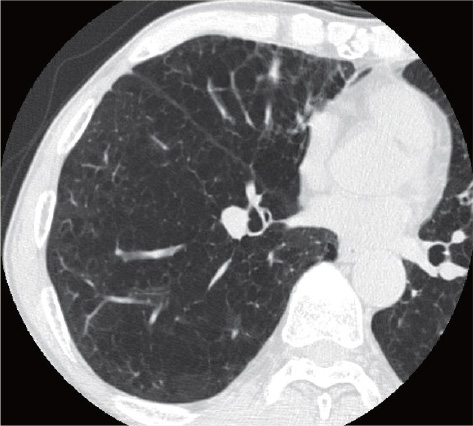
71歳男性、3年前よりCOPDで在宅酸素2Lを使用していた。肺炎で入院した際に撮影したCTで右肺舌区に24㎜大の腫瘍を指摘され、CTガイド下生検で肺腺癌と診断された。低肺機能(%FEV1.0:39.6%、%DLCO:25.3%)で手術の適応なく、気管支鏡下でゴールドマーカーを留置後、12Gy×4回の動体追尾体幹部定位放射線治療を行った。
治療後3ヵ月のCTで腫瘍は著明に縮小し、2年経過した時点で局所はわずかな瘢痕を残すのみで、明らかな転移・再発は認めていない。肺臓炎をはじめとする有害事象は認めず、QOLも治療前と同様に保たれている。
■ 治療成績
当院では14例で肺癌に対して動体追尾体幹部定位放射線治療を施行し、全例で高い精度で治療を完遂した。腫瘍に対しては従来の方法と同等の線量が照射されており、1例を除き局所制御されている。
一方、動体追尾照射を施行しない場合と比較して標的体積は平均33%縮小し、放射線肺臓炎の頻度に関係するといわれている20Gy以上照射される肺体積の割合(肺V20)は平均20.4%低減していた。有害事象はGrade 2の放射線肺臓炎を1例で認めるのみであった。
治療の所要時間は平均36分程度であり、通常の体幹部定位放射線治療の所要時間と比較してほぼ同等の時間で治療を行うことができた。
■ 今後の期待
動体追尾照射を用いることで、肺をはじめとする周囲臓器への照射線量が低減するため、安全に線量増加をすることが可能となり、さらなる治療成績の向上を期待できる。
また、これまで高線量を照射することが困難であった縦隔のリスク臓器に接する肺腫瘍に対しては、膵臓癌ではすでに臨床応用している動体追尾照射と強度変調放射線治療(IMRT)を組み合わせた動体追尾IMRTを行うことで、短期間で効果の高い治療を行うことができるようになると考えられる。
4. まとめ
ゴールドマーカーを使用することにより、X線画像上で腫瘍の位置を認識することが容易となり、正確な動体追尾照射を行うことが可能となった。またゴールドマーカーは、体幹部定位放射線治療の主な対象者となる低肺機能の患者や高齢者にも、比較的安全に留置することができると考えている。より低侵襲な患者の負担の少ない治療の臨床応用において、ゴールドマーカーが果たしている役割は大きい。