ゴールドマーカー
~世界標準の治療法としての期待を担って~

北海道大学大学院医学研究科放射線医学分野
白土 博樹 先生
・肺癌の現状と課題
厚生労働省「人口動態統計」によると、肺癌は、我が国の癌死亡率の中で第1位であり、男性では人口10万人当たり80人、女性でも30人と近年特に増加傾向にあり、その制圧は喫緊の課題である。近年、薄スライスマルチディテクターCT検査や気管支腔内超音波断層法などの発展により、小型肺癌の早期発見と術前組織診断が可能となってきた。手術の低侵襲化も進みつつあるが、肺癌は慢性閉塞性肺疾患(COPD)など呼吸機能の低下した患者に発生することも多く、より非侵襲的で効果的な肺癌治療の出現が待たれている。
・体幹部定位放射線治療
放射線治療は、画像診断やコンピューター技術の発展とともに急激に精度を上げつつある。細いビームを腫瘍だけに多方向から集中させる定位放射線治療は脳・頭頸部の腫瘍では手術に比べ侵襲度が低く良好な治療成績を上げているが、体幹部とりわけ呼吸性移動のある肺の腫瘍では困難とされてきた。しかし、最近、治療室内に透視装置やCT装置を設置し、治療直前にこれらで患者位置を合わせ、治療中は何らかの呼吸性移動対策をする体幹部定位放射線治療が、非小細胞肺癌など小型肺癌に対する優れた治療法として保険適用となった。中でも、我が国が開発した動体追跡放射線治療では、腫瘍近傍に挿入されたゴールドマーカーの位置を0.033秒ごとに自動パターン認識技術で把握でき、これを一定の位置にきた瞬間だけ同期照射により狙い撃ちできるため、体幹部定位放射線治療の中でも最も精度が高い治療として注目されている。最近では、この治療をさらに発展させ、腫瘍位置を予測し、ゴールドマーカーを追尾しながら放射線を照射し続ける動体追尾放射線治療法も出現し、空間と時間の精度を上げたこれらの治療は4次元放射線治療と呼ばれ、今後の世界標準になると期待されている。
・ゴールドマーカーの開発
肺癌自体をX線透視で正確に把握し続けることができることは極めてまれで、動体追跡放射線治療や動体追尾放射線治療では、マーカーを体内の肺癌の近傍に経気管支鏡的に挿入する手技がほぼ必須である。
ゴールドマーカーとその挿入具の開発には、北海道大学医学研究科と大学病院の呼吸器内科医とオリンパス社の忍耐強い努力があった。実際、私を含む放射線治療医は、当初、肺癌の近くに1.5mmのゴールドマーカーを挿入することは不可能であろうと思っていた。また、仮に一度挿入したとしても、すぐに脱落して役に立たないであろうと思っていた。しかし、北海道大学第一内科の面々とオリンパス社の研究者たちは、次々と難題を克服して、患者に安全な挿入方法を確立し、脱落率を低下させる方法論を見つけ出した。そして、10年を費やして、ついに薬事承認・保険収載までこぎつけたのであった。肺癌に対する動体追跡放射線治療は、呼吸器内科医の肺癌制圧に対する熱い思いと、内視鏡研究者の内視鏡に対する執念と、我々放射線治療研究者の放射線治療に対する思いが重なって初めて実現した、我が国が誇るべき融合領域・産学連携の高精度癌治療開発物語であると思う。
他国では、肺癌近傍へ経皮的にCTガイド下でマーカーを刺入し、少なからず危険な気胸を起こしている施設があると報告されている。経内視鏡的な挿入法を用いてきた方法は当然ながら比較にならないほど安全であり、動体追跡放射線治療を行われてきた北里大学病院、山口大学病院、福井県立病院、NTT東日本札幌病院などもゴールドマーカーを経気管支鏡的に安全に挿入し、優れた肺癌治療成績を上げておられる。
・ゴールドマーカーの特徴
治療中の腫瘍位置を代表するマーカーとしての性能としては、肺内のどの部位にあっても、動体追跡照射用X線透視装置でほぼ確実にパターン認識が可能である。しかし、極めて太った患者や、肝臓と心臓を通過する方向でのパターン認識率は低下する場合があるので、注意が必要である。高エネルギーの治療用X線撮影はコントラストが低いのでパターン認識にて自動抽出するには適していない が、肉眼的に位置を確認するために役に立つ場合もある。
ゴールドマーカーの体内留置物質としての適合性は、金の純度が高いため国の安全性基準を完全にクリアしている。ゴールドマーカーと挿入キットの間には特に接着剤などは使用されていないため、不純物に関しても安心して利用できる。ゴールドマーカーは、挿入されて1週間程度の間に、留置された小気管支周囲からの治癒起点で体内に固定されることが多く、その後は体内に年余にわたって留置されたままとなる。5年以上の治癒例も多数経験しているが、ゴールドマーカーが放射線肺臓炎を悪化させたり、生体に悪影響を及ぼすことを、我々は経験していない。残念ながら留置後に脱落した場合に、他小気管支へ移動・迷入したり、気管を逆流して喀出されたり、喀出の代わりに消化管に迷入することがあるが、そのことによる有害反応は全く経験したことがない。
ただ、体内のゴールドマーカーは、腫瘍との関係がずれてしまっては意味がない。よって、治療前にゴールドマーカー間の相互距離が2mm以上離れていないかをチェックし、もしそれ以上離れている場合には、再度CTを撮影するなどの工夫が必要である。経験上は、脱落や移動が起きるのは、挿入後1週間以内である場合が多く、治療計画用CTは挿入後4日以上経ってから行うことが望ましい。さらに治療開始後2週以上経過してからは、放射線による腫瘍や肺組織の収縮が起き得るので、ゴールドマーカーと腫瘍の位置を頻繁に確認することが必須である。
・ゴールドマーカーによる放射線治療
ゴールドマーカーを用いた治療は、呼吸器科医、内視鏡専門医と放射線治療医の迅速で的確な連携が必須である。呼吸器科医が患者の状況に合わせた正確な治療選択を行い、内視鏡専門医が安全にゴールドマーカーを挿入し、放射線治療医が腫瘍の移動範囲や同期条件を設定して的確な放射線治療を行うことが必要であり、どれが欠けても優れた治療成績には繋がらない。いずれの医師も、治療の成否を握っている。
患者側からみると、ゴールドマーカー挿入と動体追跡照射の考え方は非常にわかりやすいらしく、よく説明すれば、是非、その方法で治療を受けたいという方が多い。むしろ、ゴールドマーカーを入れなかった患者さんから、なぜ、自分は必要がないのか、という質問を受け、答えに窮することがある。もとより、ゴールドマーカー挿入による長期生存率向上の科学的エビデンスは、今後も追求するべき段階であるが、医師の連携がしっかりしていれば、安全性に関しては十分安心でき、局所効果向上も期待できる水準にある。
一方、放射線装置の高度化・複雑化にともない、放射線治療の安全管理体制を徹底することがますます重要になってきている。安全を目指した最新の治療法であっても、一歩管理を間違えれば患者さんに重大な障害をもたらすのが放射線治療であることを、施設ごとに確認し、管理していくことも忘れてはならない。
・治療の適応と今後への期待
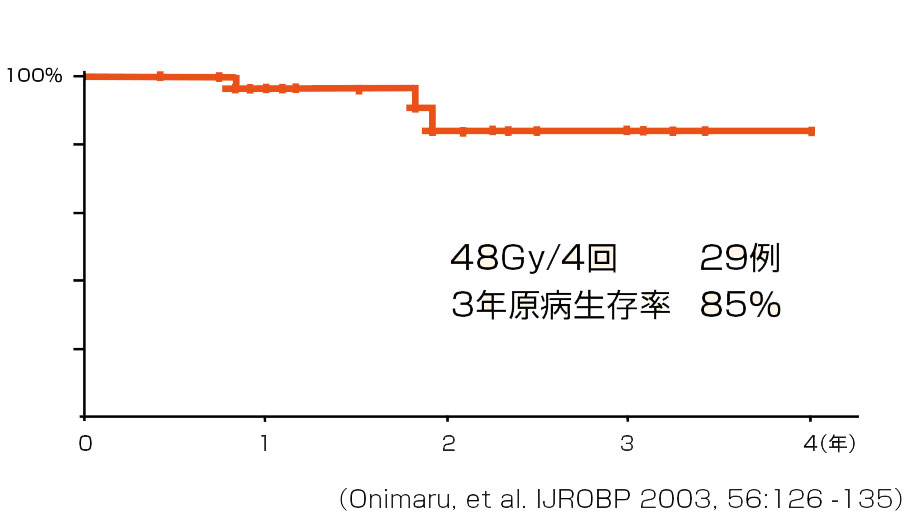
北海道大学病院では、高齢や重症の慢性閉塞性肺疾患、術後の低肺機能、心疾患などの合併症により手術適応とならないI期非小細胞肺癌に対する治療としては、ゴールドマーカーを呼吸器内科で挿入し、4~5日目に治療計画用CTを行い、1週間以内に動体追跡放射線治療にて48Gyを4回に分けて1週間で行うことが定着している。国内有数の動体追跡放射線治療装置を利用している他大学病院・癌拠点病院等へのアンケートでも、同様な結果であった。以前は高度先進医療扱いであったが、現在はゴールドマーカー挿入術から治療終了まですべて保険適用となっており、放射線治療は外来的に治療可能であり、遠方の方も1~2週間の入院で済むので、患者さんやその家族の経済的・身体的・社会的負担は少ない。低侵襲な診断技術で組織診断が可能になりつつあり、手術適応を迷う症例への適応が広がりつつある。
体幹部定位放射線治療は欧米に先んじて日本で普及が進んでいるが、このところ世界肺癌学会や米国臨床腫瘍学会でも取り上げられ、近年、急激に注目されだした治療法である。ゴールドマーカーの内視鏡的挿入術は、手技において日本が一歩先を進んでいるが、欧米でもその普及に乗り出しつつある。世界的に増加している肺癌の死亡率減少を目指して、この治療法が安全で効果的な治療として標準化していくことを、心から期待している。
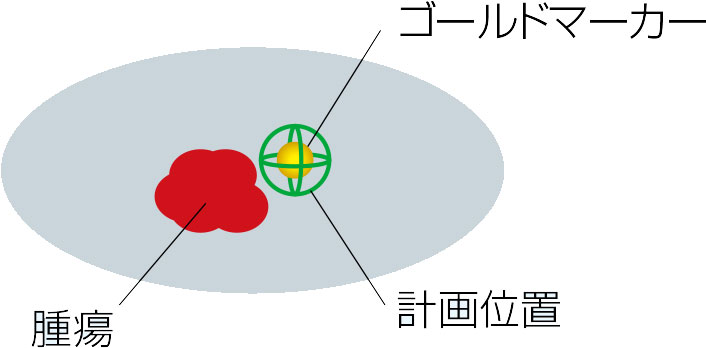
動体追跡放射線治療の概要
「動く腫瘍を固定するのが困難であるならば、腫瘍そのものに座標中心をもたせ、リアルタイムにその位置を把握して、それに合わせて放射線を照射しよう」─まさに180度逆転の発想である。この画期的な発想をもとに、白土博樹先生は画像誘導放射線照射治療の一つである「動体追跡放射線照射法」を開発し、1999年頃から臨床応用を重ねてこられた。ここでは、白土先生のお話をもとに、この治療を実施している中心的施設の一つである北海道大学病院(北大病院)のシステムの概要と治療の実際をご紹介します。
治療の概念
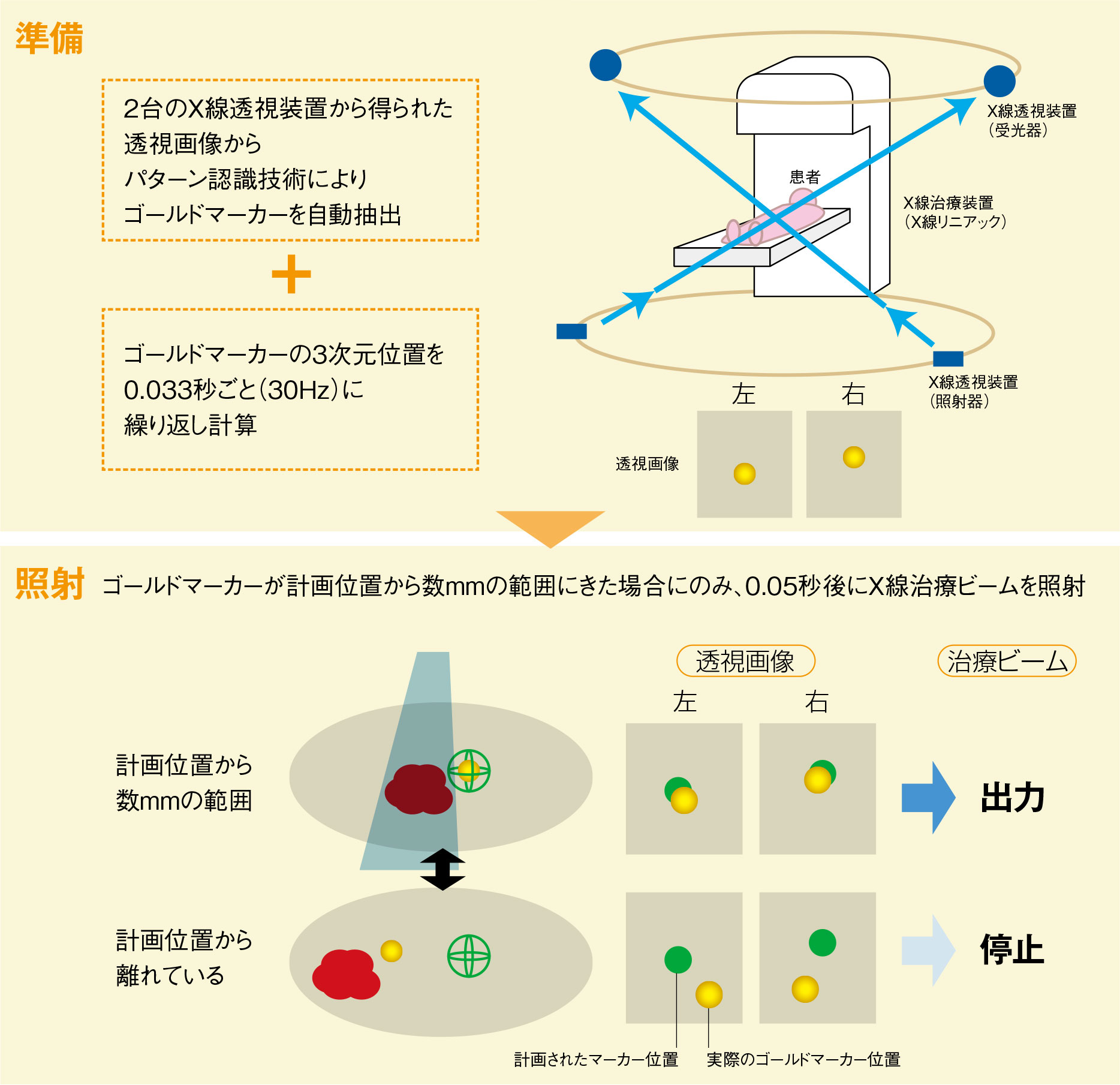
治療計画
治療
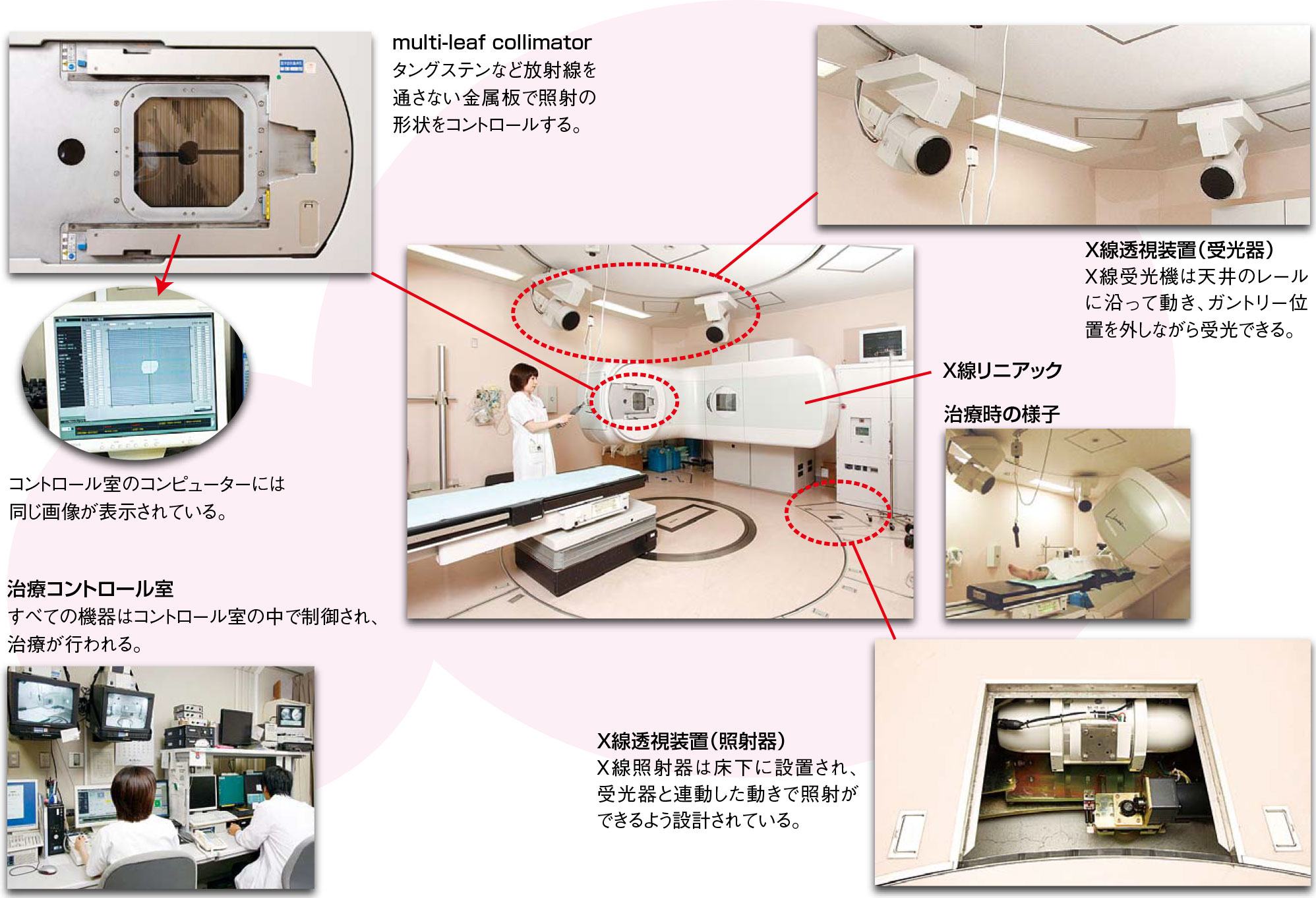
機器構成
X線リニアック
腫瘍に放射線を集中照射する放射線治療の主役の装置。北大病院で用いている装置は、通常のX線リニアックの性能をすべて備えており、4MVと10MVのX線を作り出す。
加えて、ガントリーヘッドには強度変調放射線治療(下記参照)のための60対のmulti-leaf collimatorが装備されており、これにより腫瘍部だけに効率よく放射線を照射することが可能になる。
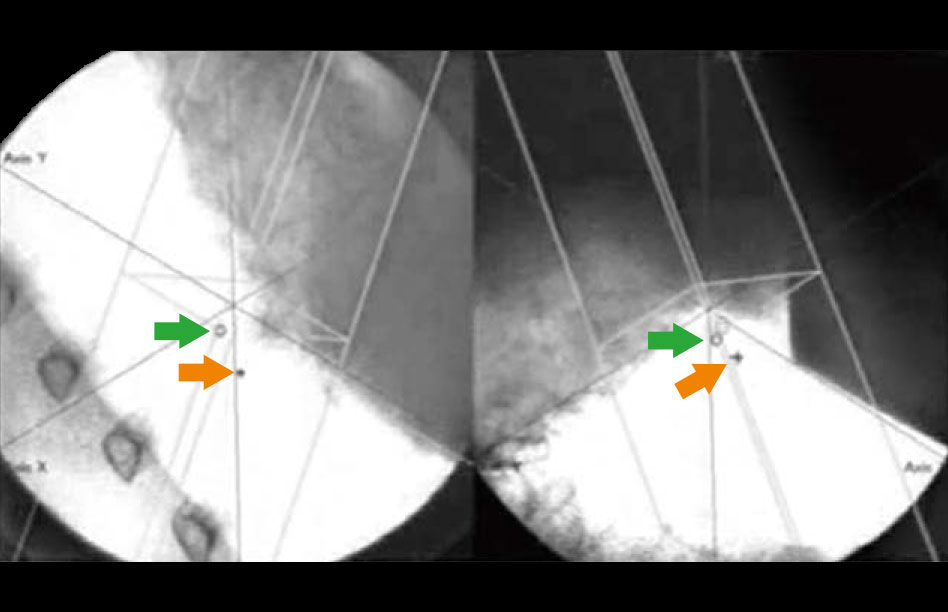
動体追跡装置
治療中、腫瘍の位置をリアルタイムに把握し、計画した位置に腫瘍がきた時だけ放射線を照射することを可能にしている重要な脇役の装置。2対のX線透視装置を天井と床の円形レール上に置き、リニアックのガントリーの位置に応じて移動させて死角なく透視できるようにしている。
透視装置のX線ビームはリニアックの治療用X線のアイソセンターを通過するように設計されている。
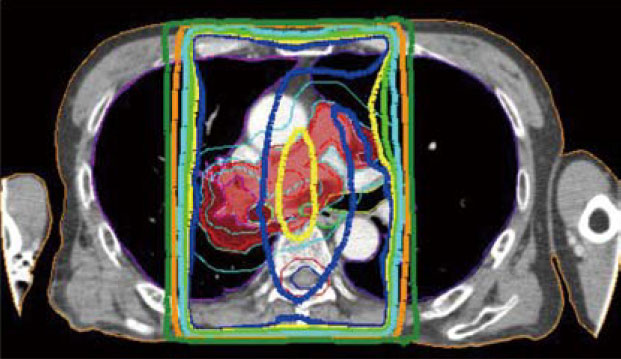
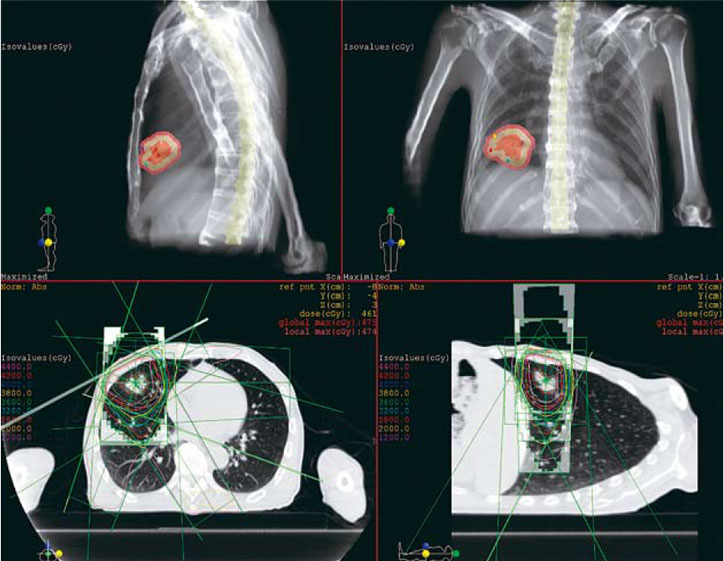
強度変調放射線治療
リニアックのガントリーヘッドに装着されたmulti-leaf collimator(多分割原体絞り)によって作られる異なった照射野の重ね合わせにより、3次元的に複雑な線量分布を得ることを可能にした技法。正常組織の線量を抑えつつ、腫瘍に投与する線量を増加させることが可能になる。
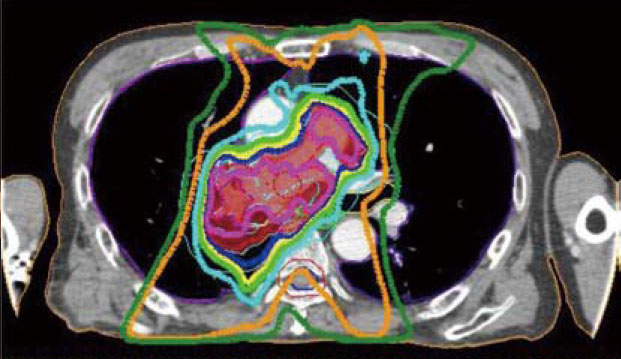
従来の治療(左図)では、腫瘍(赤の塗り潰し部分)に十分に放射線をかけるには正常の肺(黒く見える部分)に多くの放射線照射を余儀なくされるが、強度変調放射線治療(右図)では腫瘍以外へ照射される線量の低減が可能。また、大血管や脊髄へ照射される線量も低く抑えることができ、より効果的に、より安全な治療を提供することができる。
肺癌に対する動体追跡放射線治療の実際
治療成績から考えられる適応
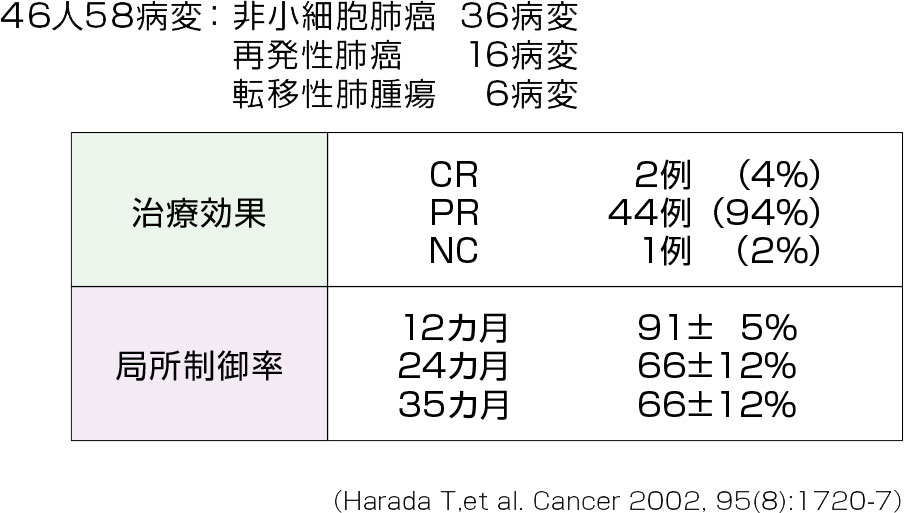
北大病院では、1999年より12年間をかけ、肺癌症例にゴールドマーカーを用いた肺癌に対する動体追跡放射線照射を実施している。
1999年当初からの第1期の試験(表1)では、既に58病変の肺癌に対して治療が行われ、I期の非小細胞肺癌の3年生存率は85%(表2)に達しており、局所制御率は90%以上である。したがって早期の肺癌では、外科手術と同等の成績ということができる。これらの成績をもとにこの治療法の適応を考えると、腫瘍径の小さい早期癌が最適といえる。
II期以上の非小細胞肺癌に対しても、強度変調放射線治療を取り入れることで、一定の治療成果が得られており、今後は適応範囲になっていくと考えられる。強度変調放射線治療は、病巣の形状に合わせて放射線を照射することができるため、正常組織への影響を最小限にしながら、従来よりも多くの放射線を腫瘍に照射することができる。同様に中枢部の肺癌に対しても、照射範囲を限定して食道や主気管支に対する放射線障害を軽減することが可能になってきており、適応の拡大が期待できる。
治療のプロセス
治療計画
1)ゴールドマーカーの留置
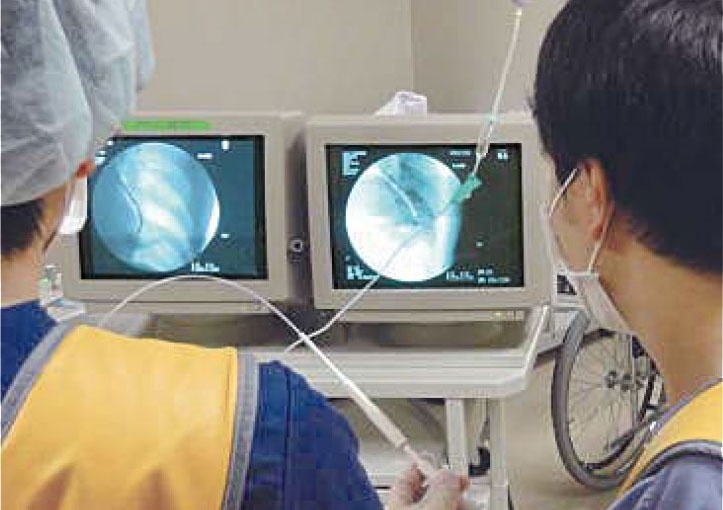
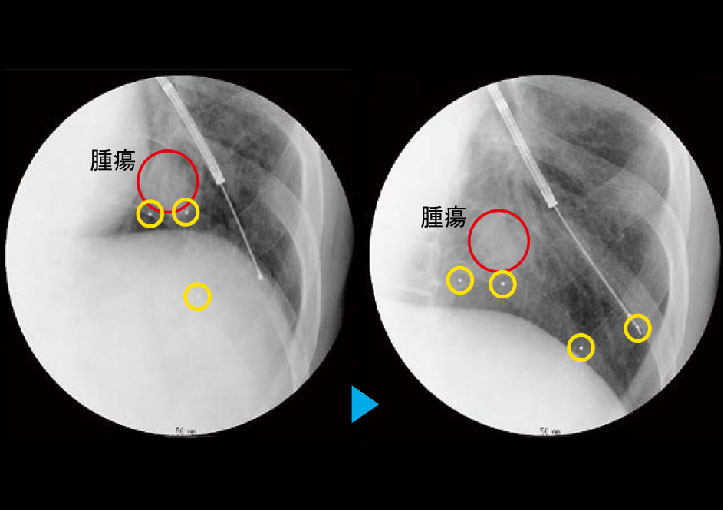
呼吸器内科において、経気管支鏡下に、通常3~4個のゴールドマーカーを腫瘍の近傍に留置する。
留置の場所は、腫瘍の場所・形状などをもとに、あらかじめおよその位置が決めてあり、状況に合わせて、下記のマーカー留置の条件をみたすように留置していく。ただし、現実的には、腫瘍中心から5cm以内に1個の挿入でも確実に精度は向上するので、患者さんの状態によっては、無理をする必要はない。
〈理想的な挿入目標・4条件〉
①腫瘍辺縁から3cm以内
②4個のゴールドマーカー
③腫瘍を取り囲むようにバランスよく挿入
④脱落しないように奥までしっかり入れる
以下、このマーカーを頼りにして綿密な治療計画を立てることで、効果的で安全な放射線治療が実現する。
2)3次元治療計画の作成
ゴールドマーカー留置後に呼吸相や体位をそろえた状態で、CTやFDG-PETなどの画像検査を行う。
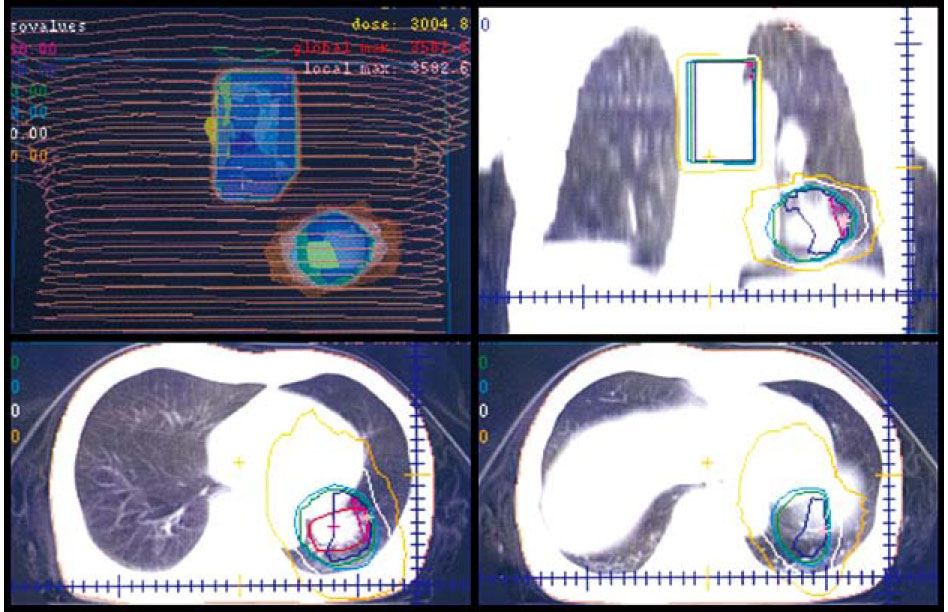
これらの2次元画像一枚一枚に、放射線腫瘍医が治療するべき腫瘍と周囲の重要な臓器と体表面とゴールドマーカーの輪郭を囲っていき、それを3次元的に再合成する。動体追跡照射では、ゴールドーマーカーと腫瘍の位置関係を3次元的に登録する重要なプロセスである。
このあと、どの方向から腫瘍に照射すれば、正常組織への副作用を減らせるかを考えながら、それぞれの方向ごとに、照射野形状や線量を決定する。小型肺癌では7~10方向を利用し、腫瘍部位に線量を集中するプランを立てる。治療位置の照射前照合は、腫瘍の形状や患者さんの状態の変化があるため、毎治療時行う。
治療
症例
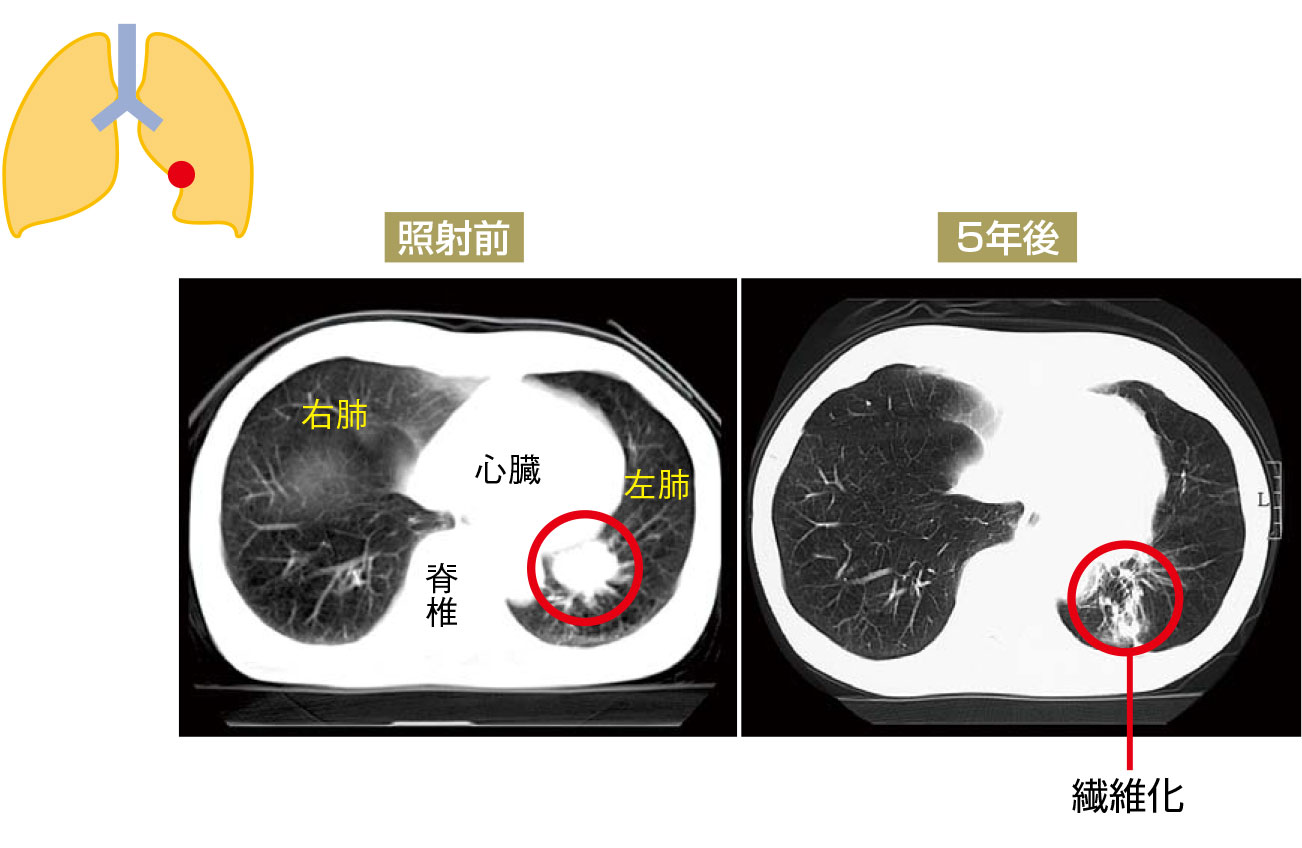
症例 1 扁平上皮癌
[病変部位]
左下葉、心臓に近い位置にできた扁平上皮癌で、前記の方法で、体幹部定位放射線治療を行った。
[治療計画]
60Gy(グレイ)を8回に分けて2週間のみの照射を行い、3cm大の腫瘍はその後消失し、同部位に放射線の繊維化がCTで認められた。経過中、副作用と思われる症状・検査結果などはなかった。心臓と大動脈の近くであったが、周囲への晩期障害もなく、その後経過は良好で、5年後CTでは再発もなく、元気に過ごしている。
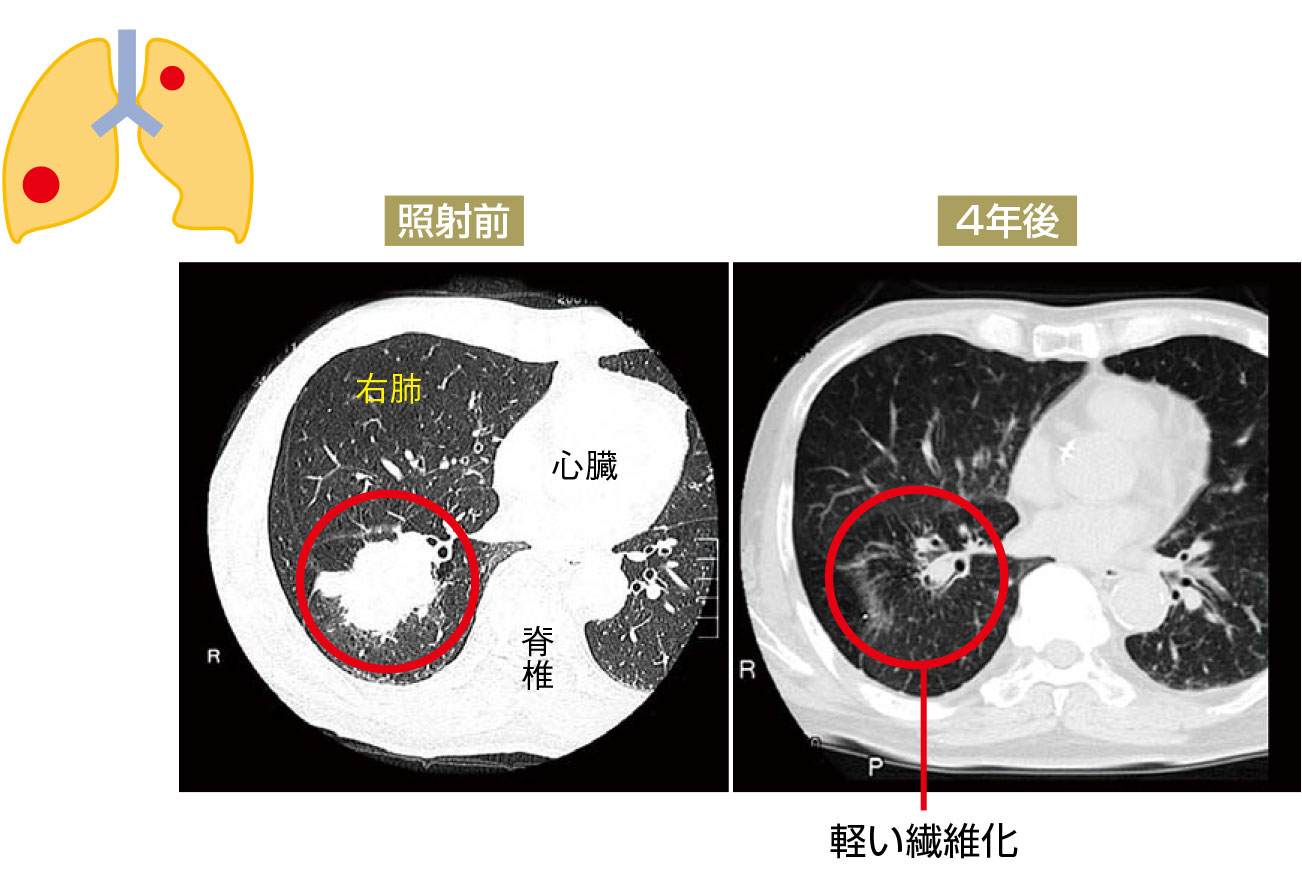
症例 2 非小細胞癌
[病変部位]
腫瘍は左上葉と右下葉にできており、右の腫瘍は4cm大、左の腫瘍は2cm大で、ゴールドマーカー留置は、両方とも問題なく行われた。
[治療計画]
10Gyの照射を4回に分けて、それぞれ1週間のみの治療を行い、腫瘍は消失し、軽い繊維化を残すのみとなった。経過中、放射線照射に伴う症状や他の副作用なく、4年後の時点で、治療された腫瘍は再発なく、晩期障害も認めていない。
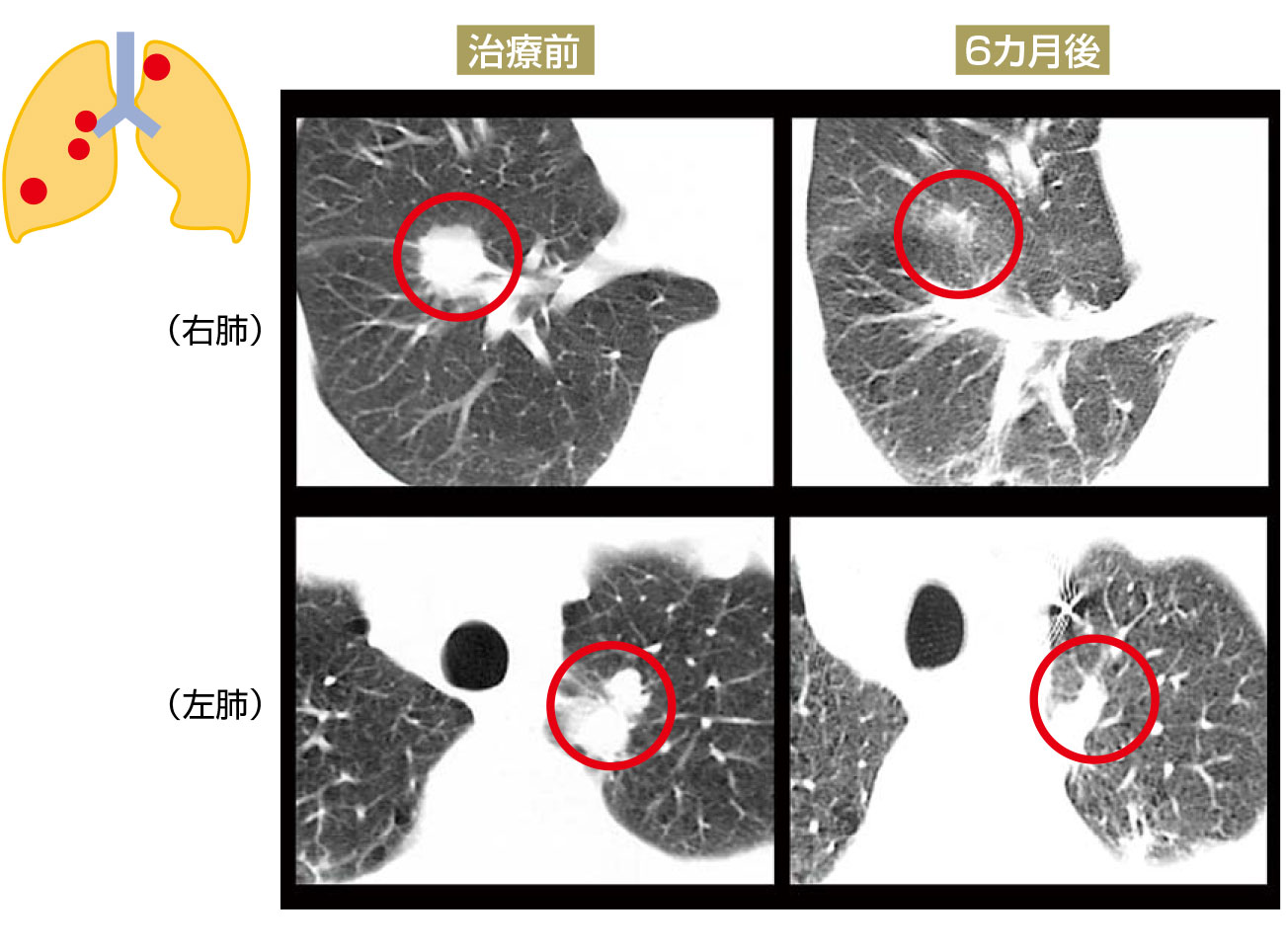
症例 3 扁平上皮癌・腺癌
[病変部位]
腫瘍は左上葉に1つ、右下葉から右中葉に3つできており、4つの腫瘍ができていた。右の腫瘍は1つが扁平上皮癌、2つが腺癌、左の腫瘍は扁平上皮癌であった。ゴールドマーカー留置は、それぞれの腫瘍近傍に対して行った。
[治療計画]
それぞれに対して48Gyの照射を4回に分けて1週間で治療を行い、1~2cmの腫瘍が消失した。その後予後は良好で5年後のCTでは腫瘍は消え再発もなく元気に過ごしている。
- Keyword