EBUS-GS手技の実際
GS挿入前、気管支鏡をできるだけ末梢まで挿入したところで鉗子口から生食を5~8mLゆっくり入れる。こうすることで、気管支内腔が広がりGSを気管支内腔に入れやすくなる。
ただし、病変がすりガラス状陰影(GGO)の場合にはEBUSで病変が確認できなくなることがあるため、生食の注入はしない。
1) ガイドシースの対象病変への誘導
胸部単純写真、X線透視、断層撮影(トモシンセシスなど)、CT、ナビゲーションから病変に関与すると予想される気管支に、先ほど準備したGSを被せた超音波プローブを挿入していく。
気管支鏡の先端を病変に向けることが重要である。具体的 には、胸部 CTで腹側~背側のどのあたりに病変が存在して いるかを確認し、どの程度スコープを回転させる必要がある かを事前にシミュレーションしておく。
2) EBUSの描出
超音波振動子を動かした状態で強い屈曲をしている箇所 を通すとプローブに負荷がかかるため、気管支内腔に入 れる際は、超音波振動子はフリーズさせておく。
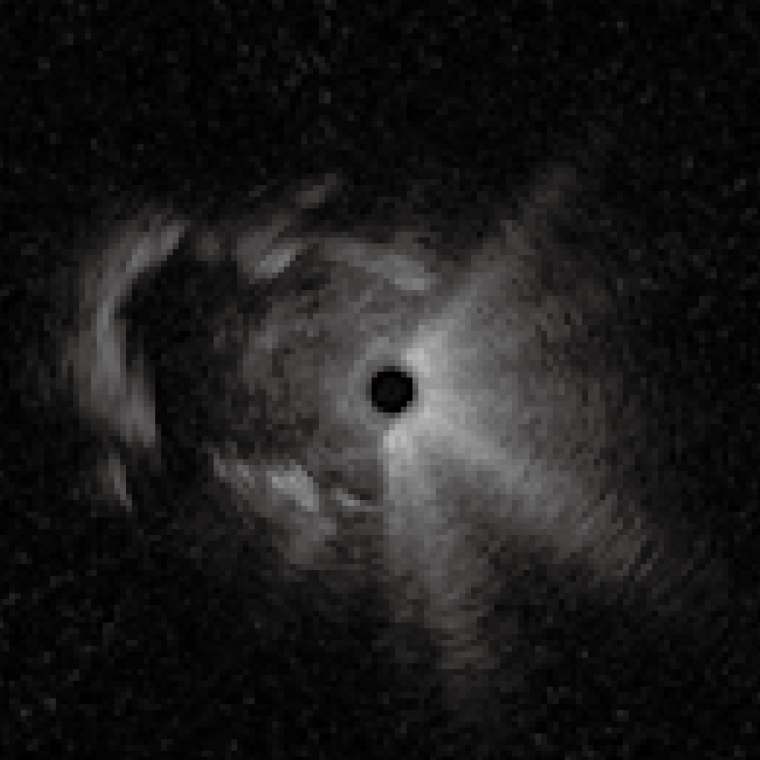
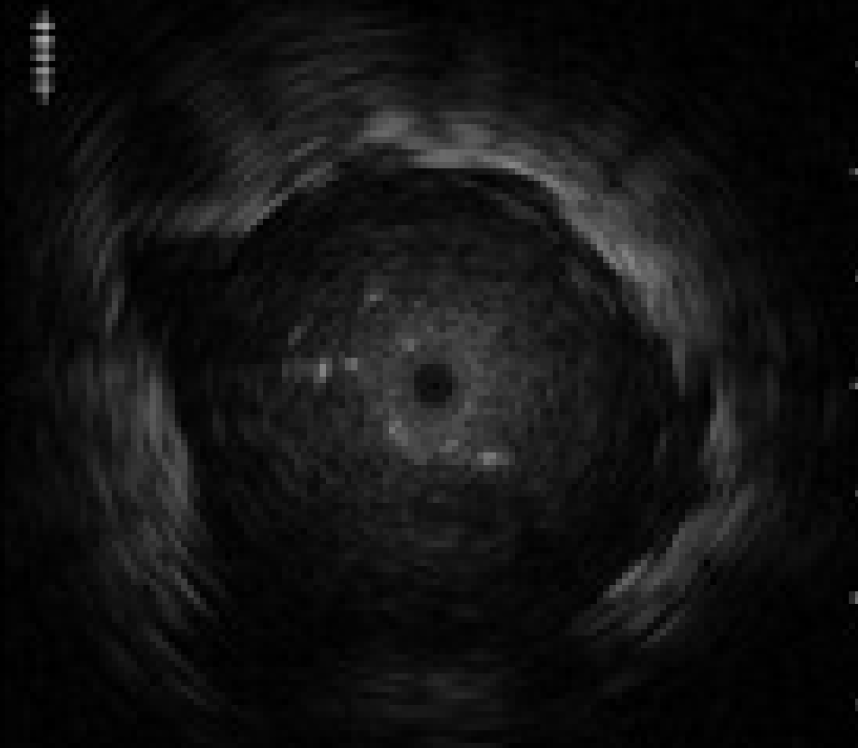
X線透視下でプローブを気管支内腔に挿入していく。 X 線透視下で病変位置とプローブの位置を確認した後、フ リーズを解除する。プローブと GSを手前に引いてくると きにEBUS画像で最も病巣の内部構造を示す画像を記録 する。EBUS画像で病巣を観察しながらGSを引き、病巣 の断面が小さくなる病巣内の近位側でGSを引いておく。
3) プローブ画像割れ
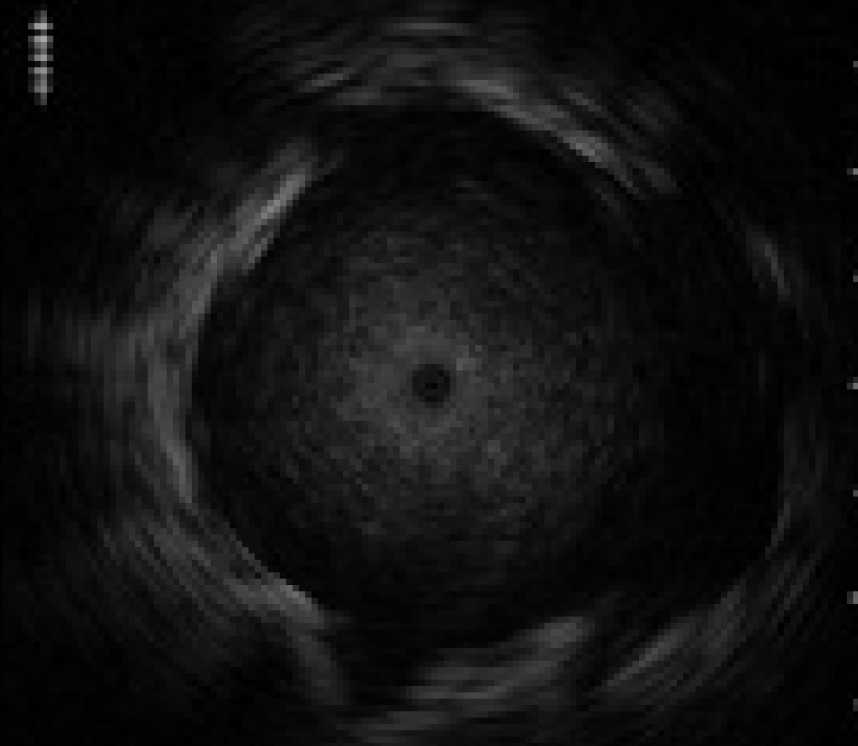
プローブの振動子部分が胸膜や気管支などに当たり、つっかかると画像が割れる場合がある。その場合、〈図8〉に示すように放射状にノイズが走ることがある。この状態で無理にプローブを押し進めるとプローブが破損する場合があるので、無理に押し進めないようにする。
超音波プローブが病巣に入らない場合の解決方法
① 気管支鏡画像下に気管支を選び直す
② X線透視下で気管支を選び直す
病変近傍まで超音波プローブを誘導したあと、X線透視下で気管支鏡のUp&Downを用いてプローブを病変の方向に向ける。プローブを病変の方向に向けた状態で、X線透視を見ながらプローブを引いてくる。気管支分岐部があればプローブ先端がごくわずか病変部に向かって動くことがあり、それが分からない場合でも手前に引いたプローブを再度入れるとうまくいく場合もある。
③ 超音波画像下で気管支を選び直す
病変の辺縁が描出できる場合は、EBUS画面を観察しながら気管支鏡のUp&Downでプローブが病変に近づくか離れるかを確認する。プローブを病変方向に近づけるようスコープアングルをかけ、EBUS画像を見ながらプローブを手前に引いてくる。その途中に病巣に向かう気管支分岐部があれば手前に引いたプローブを再度挿入すると、病巣内に誘導できる場合がある。
④ 誘導子を用いる
1~3でも病巣内へ誘導することが困難な場合、誘導子(CC-6DR-1)を用いる。GSは動かさずにプローブを抜去し、誘導子を入れてGS先端から出す。誘導子先端を病巣の方向に回旋し、誘導子先端を病巣の方向に屈曲させた後(軽く屈曲させるのがコツであり、強く屈曲させると気管支を損傷する可能性あり)、手前にゆっくりと引き、気管支分岐部があれば誘導子先端がごくわずか病変部に向かって動くことがあり、それが分からない場合でも手前に引いた誘導子を再度入れるとうまくいく場合もある。誘導子に沿わせるようにGSを挿入して留置し、誘導子を抜いたあとで超音波プローブを再挿入し、病変の内部に入っているかどうかをEUS画像で確認する。
4) GSの留置
EBUS画像で、病巣を観察しながらGSを引き、病巣の断面が小さくなる病巣内の近位側でプローブをフリーズさせた状態で抜去する。
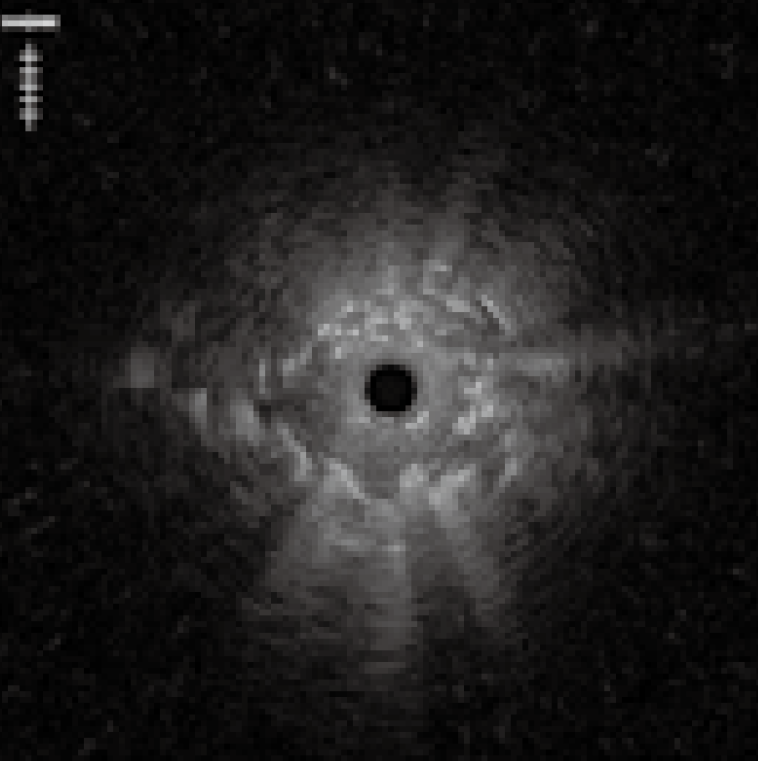
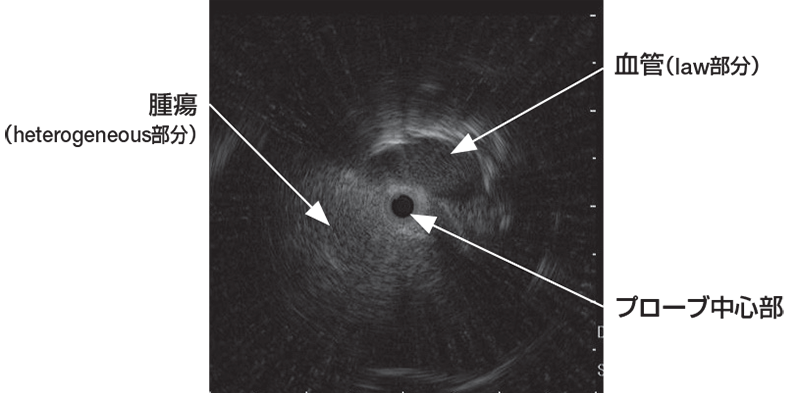
その際、超音波振動子を作動させながら末梢病変をEBUSで描出した後、術者はGSを保持し、助手がGSの位置は動かさずにプローブのみをGSからゆっくり抜き、超音波振動子をGS内に入れ、またプローブを挿入し超音波振動子をGSから病変内へ出す操作を繰り返す。振動子全体がGS内に入ると、GSに超音波が反射され減衰が生じ、EBUS画像の輝度が暗くなるので、このEBUS画像の変化を確認し、GSが肺末梢病変の内部に留置されているかを確認する〈図9〉。
この操作をしている時、透視でGS先端マーカーがどの位置にあるか、記憶しておく。
5) 細胞・組織採取
GSの中に細胞診ブラシや生検鉗子を、先ほど準備したストッパの位置まで挿入する。生検は、通常5個程度の組織検体が得られるまで繰り返し行っている。
(監修ドクターは、細胞診ブラシ→生検鉗子→細胞診ブラシ…の順番で細胞・組織採取をしている。)
① 細胞診ブラシ
助手が抵抗感を感じながらブラシを病変内に押し出し、その押し出したポイントからGS出口までを擦過してくる。特に胸膜直下の場合は、押し出すブラシの長さに注意が必要である。
② 生検鉗子
GSを動かさずにカップが開けば最良だが、そうならない場合は、X線透視下で術者がGS越しにわずかに動かす (jabbing)ことで開く。鉗子を病巣に押し付けるようにし、組織の硬さを感じながらゆっくりカップを閉じる。
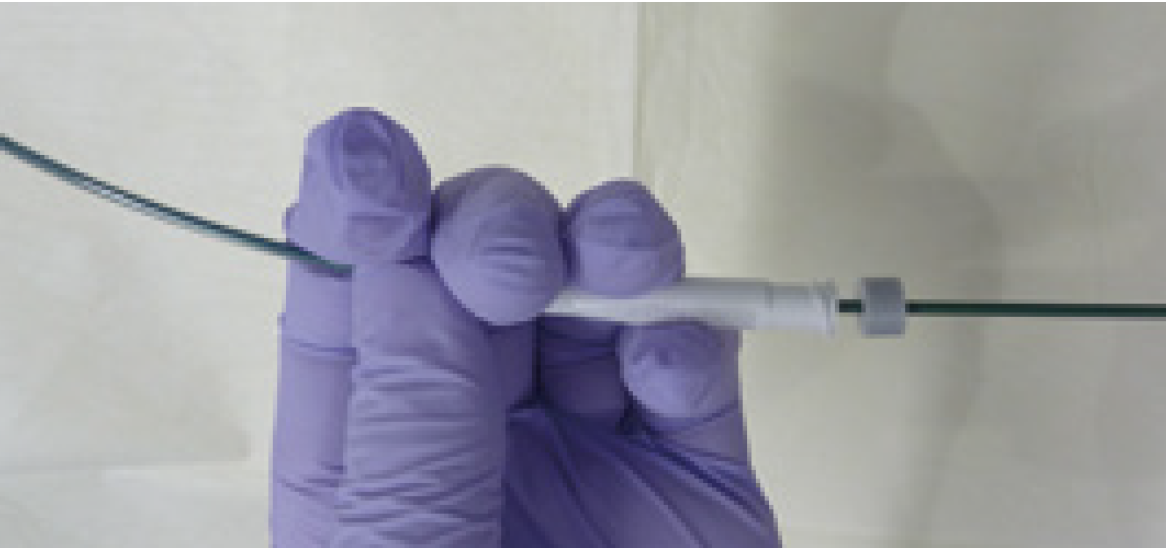
細胞診ブラシや生検鉗子をGSから抜去する際、写真のとおり、GS接続部およびシース部を一緒に持って、デバイスを抜去する〈図10〉。この動作をしなければ、GSが伸びたりじゃばら状になるなどして、デバイス入れ替えができなくなる。
6) GSの抜去
止血をする場合は、2~3分シースを生検部位に残すことで、圧迫止血の効果が得られる。2~3分留置後、GSを抜去し止血を確認する。また、シースを抜去した後、シース内の細胞を生食で洗い出し細胞診や培養検査に提出する。
7) 検体処理
*出雲 雄大 先生の方法
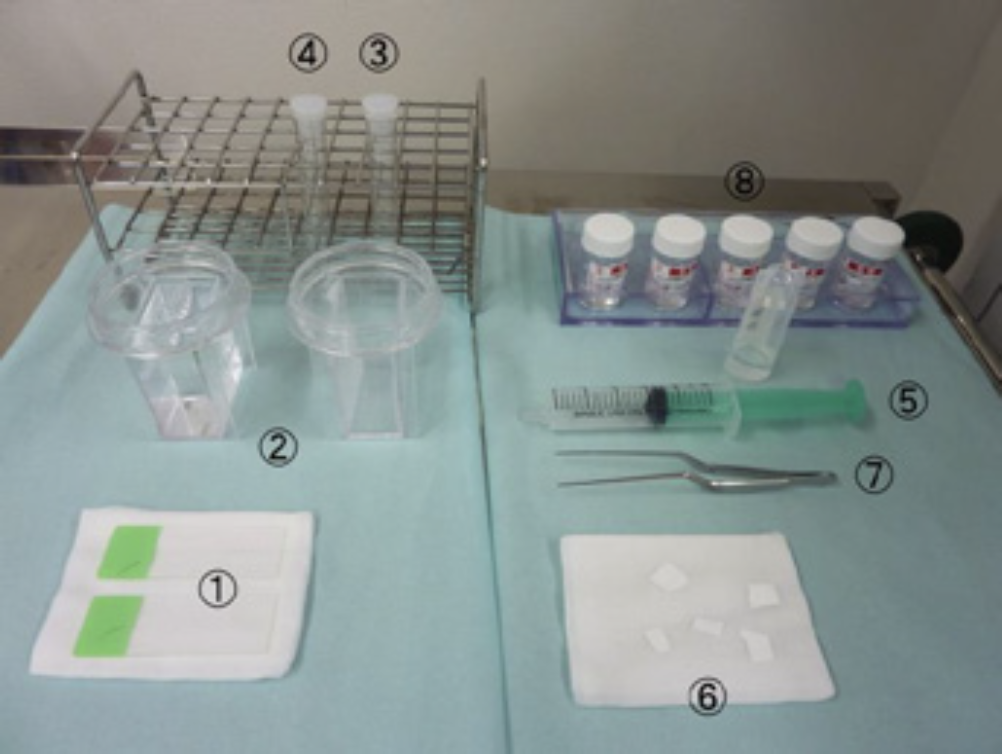
①検査開始前に、検体処理の準備を行う
a)細胞検体処理
–スライドグラス ①
–パパニコロウ染色用の95-97%エタノールの入ったコンテナ ②
–ブラシおよび生検鉗子洗浄用のバイアル③
–ガイドシースフラッシュ用のバイアル ④
–3mlの生食が入った20mLシリンジ ⑤
–空の20mLシリンジ ⑤
b)組織検体処理
–組織検体を載せるろ紙 ⑥
–ピンセット ⑦
–ホルマリン瓶 ⑧
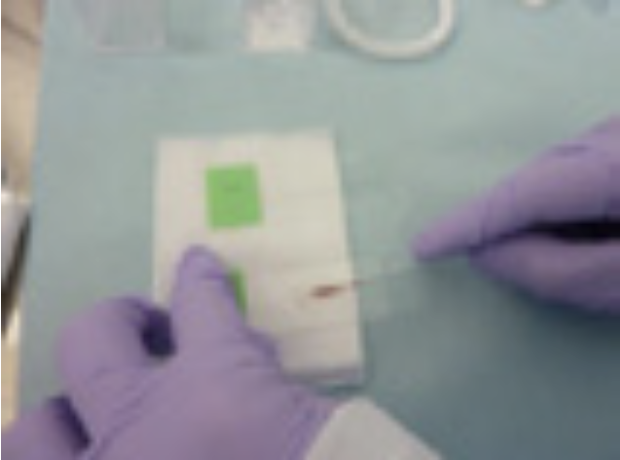
②ブラシシースからブラシ本体を押し出し、ブラシに付着した検体を2枚のスライドガラスに塗抹する〈図11〉。1枚は可能な限り速やかに湿固定(エタノール)をする→パパニコロウ染色用〈図12〉、もう1枚は乾燥固定(迅速診断、Diff-Qick染色)に用いる〈図13〉。その後、ブラシ本体を生食3mLが入ったバイアル内で洗浄し、残余検体を液状細胞診および培養検体とする〈図14〉。



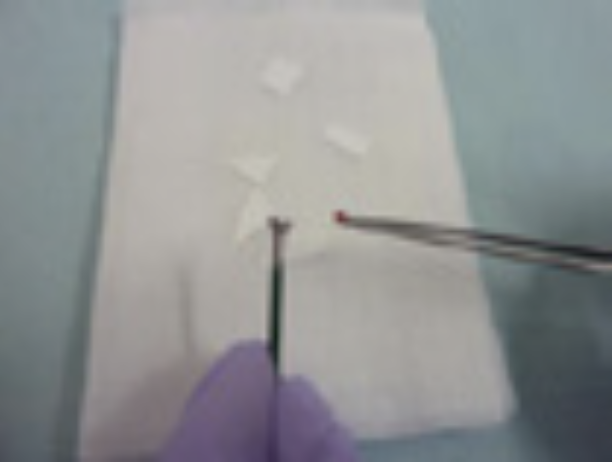
③生検鉗子カップを開き、採取した検体をろ紙の上に載せ、ホルマリン固定を行う〈図15, 16, 17〉。捺印細胞診が必要な場合は、2枚のスライドガラスを湿固定と乾燥固定用に分け、細胞診標本を作る〈図18〉。湿固定用のスライドグラスは捺印後できる限り速やかにエタノールの入ったコンテナへ入れる。生検鉗子を生食3mLが入ったバイアル内で洗浄し液状細胞診および培養検体とする〈図19〉。

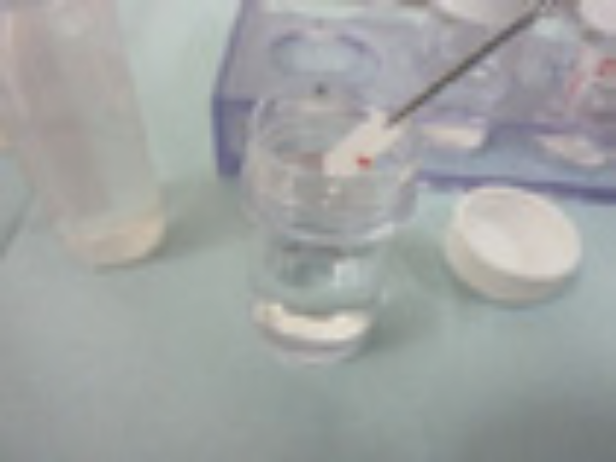
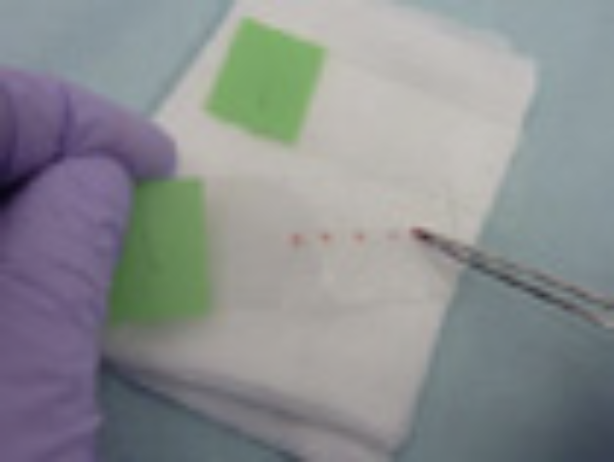

④生食3mLが入ったシリンジでガイドシース内腔の検体をバイアル内にフラッシュし〈図20〉、その後空のシリンジを用いてフラッシュ後のガイドシース内に残った生食および検体を空気で押し出し回収する〈図21〉。


- Content Type